在癌症研究中,最難掌握的往往不是晚期腫瘤的侵略性,而是早期癌化的「臨界點」——那個從良性病灶轉向惡性轉化的瞬間。這篇發表於《Signal Transduction and Targeted Therapy》的研究,透過 AI 整合的空間多重體學(Spatial Multi-omics),首次描繪出早期胃癌(Early Gastric Cancer, EGC)發展的「免疫抑制微環境」,並揭示 NAMPT 與 AREG 兩條訊號軸如何驅動癌化。
🧬研究背景:胃癌的起源不只是組織病理,更是微環境的重編程
根據 Correa 模型,胃癌的演化路徑從正常黏膜 → 慢性胃炎 → 萎縮性胃炎 → 腸化生(Intestinal Metaplasia, IM)→ 異型增生 → 癌症。IM 被視為癌前病變的關鍵節點,但目前臨床上仍缺乏有效的預測與干預工具。
本研究突破傳統橫斷式分析的限制,改採「空間連續」的 ESD 樣本(Endoscopic Submucosal Dissection),從同一病患的正常黏膜一路追蹤至腫瘤核心,建立首個早期胃癌的時空演化圖譜。
🧪實驗設計邏輯:AI 模型 stMVC + 空間轉錄體學 + 單細胞 RNA 定序
研究團隊整合以下技術:
- 空間轉錄體學(Spatial Transcriptomics, ST):使用 10X Genomics Visium 平台,分析 8 位病患的 ESD 樣本,涵蓋正常、IM、腫瘤區域。
- 單細胞 RNA 定序(scRNA-seq):分析 4 位病患的配對樣本,共取得 16,839 個細胞,辨識出 12 種細胞類型。
- AI 模型 stMVC:整合基因表現、空間位置與病理影像,建立疾病進程的多視角圖譜。
這種跨平台整合的分析方式,正是 #TissueGnostics 在空間影像分析領域所強調的「多維度整合」精神。
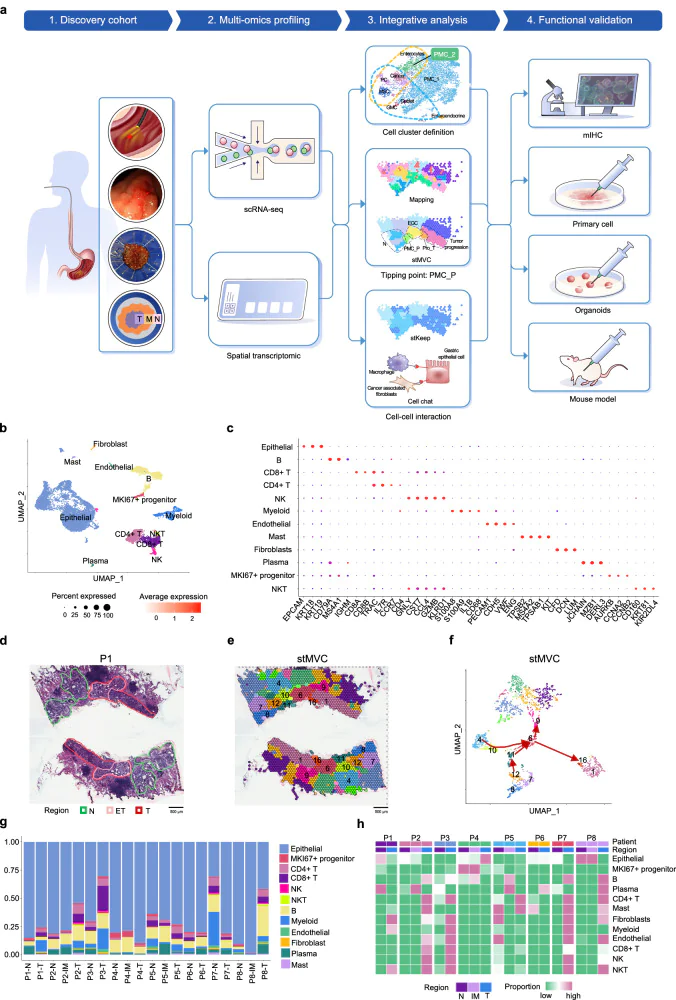
🔍五大重要發現
1️⃣ 發現癌化起始細胞:PMC_2(Pit Mucous Cell subtype 2)
- 這是一群具有幹性(stemness)與發炎特徵的上皮細胞,表現 IL1B、PHLDA1、ITGA2。
- 與傳統的腸化生(IM)細胞不同,PMC_2 更接近癌細胞,具有高度染色體變異(CNV)。
- RNA velocity 分析顯示:PMC_1 → PMC_2 → Cancer cell 是癌化的演化路徑之一。
👉 意涵:PMC_2 是早期胃癌的起始細胞,具備轉化潛力。
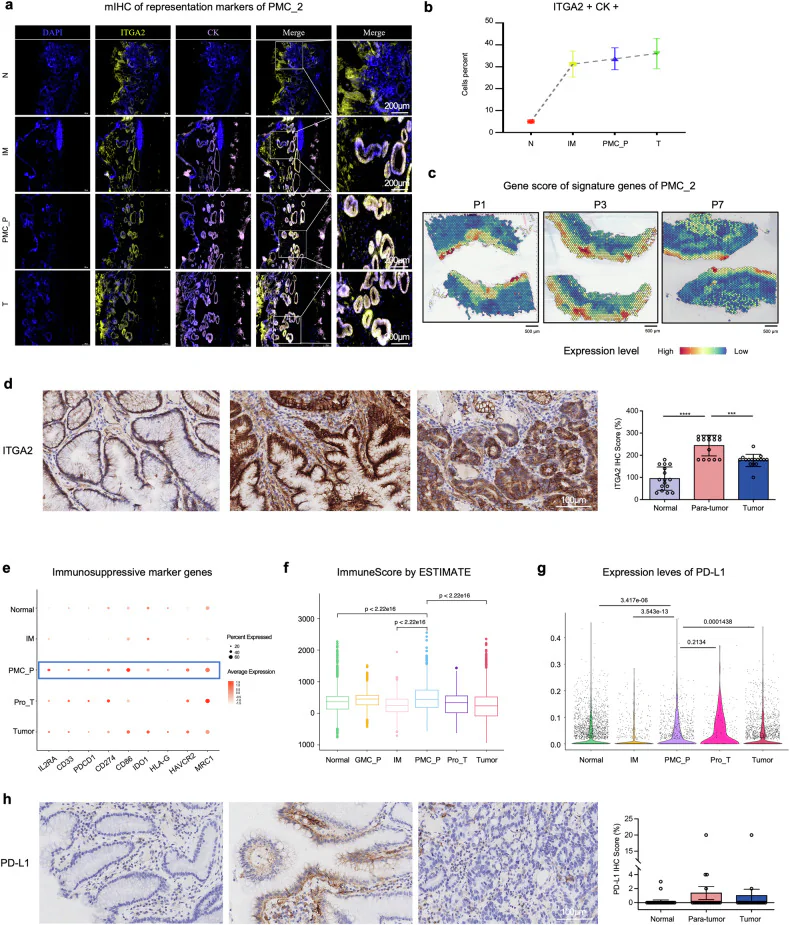
2️⃣ 定義癌化臨界微環境:PMC_P(Precancerous Pit Mucous Cell niche)
- 空間轉錄體學分析顯示,PMC_P 區域細胞表現 NAMPT、AREG、PD-L1、IDO1、HLA-G 等免疫抑制分子。
- PMC_P 區域的 PMC_2 細胞與巨噬細胞、纖維母細胞形成強烈細胞間訊號軸:
- NAMPT → ITGA5/ITGB1(PMC_2 → Fibroblast)
- AREG → EGFR/ERBB2(Macrophage → PMC_2)
👉 意涵:PMC_P 是癌化的「信號交匯點」,形成免疫抑制微環境,促進癌細胞存活與逃逸。
3️⃣ 建立癌前細胞系與 Organoid 模型,驗證 NAMPT 與 AREG 的致癌功能
- 在癌前細胞與 Organoid 中加入 NAMPT 或 AREG,可顯著促進細胞增殖、上調 PD-L1、HER2、EGFR 表現。
- NAMPT 可活化纖維母細胞,誘導 CAF 標記(FAP、α-SMA、VIM)上升。
- AREG 主要由 M1 巨噬細胞分泌,促進 PMC_2 癌化。
👉 意涵:NAMPT 與 AREG 是驅動癌化的關鍵分子,具備治療與預防潛力。
4️⃣ 動物實驗證實:抑制 NAMPT(FK866)與 AREG 可延緩癌化
- 使用 CEA-SV40 小鼠模型,給予 FK866(NAMPT 抑制劑)與 anti-AREG 抗體治療。
- 結果顯示癌前病灶形成率顯著下降,病理切片顯示癌化程度減輕。
- Western blot 顯示 PD-L1、pSTAT1、pp38、pp65 等致癌路徑被抑制。
👉 意涵:NAMPT/AREG 雙重抑制可望成為早期胃癌的預防策略。
5️⃣ 臨床樣本驗證:PMC_P 區域的基因表現與預後密切相關
- 在 TCGA 資料庫中,PMC_P 區域的 7 個基因(如 RNASE1、LGR4、CAPN8)表現與存活期負相關。
- 在 21 位 EGC 病患中,PMC_P 區域 NAMPT、AREG、PD-L1 表現顯著上升。
👉 意涵:PMC_P 區域的分子特徵可作為早期診斷與風險分層的依據。
🧠TissueGnostics 技術貢獻:從空間影像到細胞互動的精準量化
本研究大量使用多重免疫組織化學(mIHC)與空間定量分析,正是 TissueGnostics 技術的強項:
- TissueFAXS Spectra SL:支援多通道螢光掃描,解析 PMC_2、Fibroblast、Macrophage 的空間分布與共定位。
- StrataQuest:進行細胞分割、訊號量化與空間關聯分析,協助辨識 NAMPT 與 AREG 的細胞來源與受體表現。
這些技術讓研究者能夠從「細胞層級」理解癌化微環境的動態變化,而非僅停留在組織病理層面。


💡臨床與轉譯意涵:NAMPT/AREG 可望成為早期胃癌的預防標的
- 細胞實驗與 Organoid 模型:NAMPT 與 AREG 可促進癌前細胞增殖、上調 PD-L1、HER2、EGFR 表現。
- 動物實驗(CEA-SV40 小鼠):抑制 NAMPT(FK866)與 AREG 可延緩癌化進程,降低病灶形成率。
- 臨床樣本驗證:在 21 位 EGC 病患中,PMC_P 區域 NAMPT 與 AREG 表現顯著上升,具臨床相關性。
這些結果顯示,NAMPT 與 AREG 不僅是癌化的驅動因子,更可能成為早期介入的治療標靶。
🧭結語:從空間體學到臨床轉譯,TissueGnostics 助力癌症預防新策略
這篇研究不只是一次技術整合的展示,更是對「癌症起源」的深度探索。透過 TissueFAXS 與 StrataQuest 的空間定量能力,研究者得以精準描繪癌前微環境的細胞互動與訊號軸,為早期胃癌的預防與診斷開啟新可能。
作為 TissueGnostics 在台灣的技術推廣夥伴,我們致力於協助研究者從科學問題出發,打造更高解析度、更具臨床價值的影像分析流程。
Reference: Spatiotemporal multi-omics analysis uncovers NAD-dependent immunosuppressive niche triggering early gastric cancer. doi: 10.1038/s41392-025-02390-w
